Newman投影式
今回は、Newman投影式について勉強していきましょう。
本題に入る前にまず、押さえておきたいのですが
分子は本来、3次元構造をとるということを確認したいです。
高校化学の教科書の有機化学のところを改めて確認してみると、あまり3次元的なことには触れておらず (今は違うかも) 、それよりかは物質Aと物質Bを反応させると物質Cができるみたいな内容が多い印象だったのでここから確認しました。
そんなの常識、という方は申し訳ありませんでした。
そんなの知らなかった、という方は、有機化学のイメージが変わると思うので、ぜひ一緒に勉強していきましょう。
(一緒に勉強していけばもしかしたら、反応条件と反応原子をただ暗記する有機化学のイメージも変わるかも?)
では本題に入りましょう。
この記事では、Newman投影式がどのようなものなのかについて勉強していきます。
説明に使う分子例として、エタンを例に話を進めていきます。
エタンの構造を3次元的に書くと図1に示します。
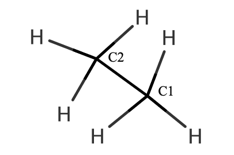
図1のエタンの3次元的な表し方を「木びき台表示」というらしいです。
また、より一般的な3次元的な表し方は、「くさび型表示」があります。
(これは大学受験の問題で見たことがあるので知っている方も多いかもしれません。)
この記事では図1の手前の炭素をC1、奥の炭素をC2とします。
図1のようなエタンは全て単結合であり、同時にσ結合です。σ結合は軸対称性の結合なので、単結合は回転できます。
ここで、単結合周りの回転による原子配列の違いは、「立体配座」と呼ばれ、あるとりえる配座がもつエネルギーが極小となる立体配座は「配座異性体」と呼ばれます。
この、配座異性体を表現するのに「Newman投影式」があります。
例を図2で示します。

図2のように、C1-C2結合の延長線上からみて、2つのCを1つの円として表現します。C1のC-H結合は、この円の中心に届く線で表し、C2のC-H結合は、円の周囲から出ている線で表現します。
また、単結合は回転できるので、 C2を60°右に回転した配座異性体を図3に示します。
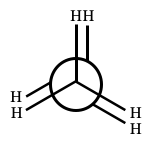
ここで、考えついているかもしれませんが、図2と図3で、エネルギー的に低く安定な配座異性体は図3です。
なぜかというと、図2では、C-H結合が互いに出来るだけ離れている配座 (ねじれ型配座) であるのに対し、図3ではC1とC2の、互いのC-H結合が近づき、重なり合っています (重なり型配座)。
C-H結合が重なることで、C1に結合しているHとC2に結合しているHとの「立体障害」が発生し、図3の方が相対的に不安定な配座となります。
この、何もエネルギーを使わなければ、より安定な方を取りやすいというのは、分子だけの世界ではなく、色々現実世界でも言えるかなと思います。
例えば部屋の掃除など、エネルギーを使わなければどんどん散らかっていきますよね。
(これはよくエントロピーの例で出される例ですが笑)
最後に、Cを回転していった時に、エネルギーがどのような関数になるのかを見ていきましょう。図4に示します。
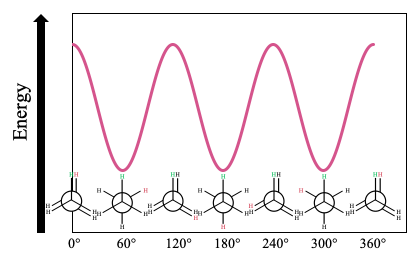
図4の横軸が、C2の炭素の右回りの回転角度、縦軸が回転角度に対応するエネルギーです。
見てもらったらわかる通り、sinやcosのような曲線になります。また、重なり型配座をとる時にエネルギーが極大になり、ねじれ型配座の時に極小を取ることがわかります。
まとめ
Newman投影式は、配座異性体を表現する方法である。
今回は以上です。
最後まで読んでくださりありがとうございます。